- CARBOCHIMIE ET PÉTROCHIMIE - Carbochimie
- CARBOCHIMIE ET PÉTROCHIMIE - CarbochimieLa carbochimie est l’industrie de la transformation chimique des houilles et de leurs dérivés. Elle naquit avec l’emploi du coke dans le traitement des minerais de fer et avec la production du gaz d’éclairage à partir du charbon. La distillation de la houille fournissait des sous-produits volatils (goudrons et gaz) que l’on chercha à utiliser. Ils servirent de matières premières à l’industrie de la chimie organique et celle-ci, du reste, se développa à l’origine dans les grands pays charbonniers et particulièrement en Allemagne. La carbochimie a permis la création des industries des engrais azotés, des carburants synthétiques, des matières plastiques et des textiles synthétiques (fig. 1). Les goudrons sont, encore aujourd’hui, la plus importante matière première de l’industrie des colorants, des produits pharmaceutiques et des explosifs. À partir de 1925, de nouveaux besoins ont surgi que la carbochimie n’a pu satisfaire et qui sont à l’origine de la pétrochimie. On découvre chaque jour de nouvelles applications du pétrole, souvent au détriment des produits offerts par la transformation chimique du charbon. Cependant, beaucoup voient dans le développement accéléré de la carbochimie le moyen de sauver le charbon combustible, que des esprits peu réalistes considèrent déjà comme une énergie du passé, le présent appartenant au pétrole et au gaz naturel, en attendant l’énergie nucléaire de demain. En réalité, la carbochimie permet aujourd’hui de valoriser le charbon et assure ainsi une meilleure rentabilité aux houillères, mais elle ne peut, dans l’état actuel des techniques et de la concurrence mondiale, avoir l’ambition de jouer le rôle principal dans la consommation de charbon. Celui-ci reste avant tout un combustible. Un travail considérable se poursuit actuellement dans le domaine de la recherche scientifique pour diversifier les débouchés de la houille, matière première chimique. Un compromis est, d’autre part, nécessaire entre la carbochimie et la pétrochimie qui peuvent être complémentaires et se développer parallèlement.1. HistoriqueEn 1745, Caron, en Écosse, découvrait que la houille pouvait être cokéfiée et constatait que le coke, ainsi fabriqué, pouvait remplacer le charbon de bois dans les hauts fourneaux. Après l’invention de la machine à vapeur et des chemins de fer, cette découverte allait favoriser le développement de la sidérurgie. Comme l’Angleterre, la Ruhr se lançait, en 1821, dans la production du coke et le premier haut fourneau était mis en service en 1855. Le coke était alors produit dans des fours ouverts dits fours à ruche et les sous-produits étaient brûlés. La découverte par Perkins, en 1856, du premier colorant dérivé de l’aniline, la mauvéine, et la mise au point par Verguin, en 1858, à Lyon, du procédé de fabrication de la fuchsine, à partir d’aniline et de toluidine, amorcèrent un développement important de sous-produits, tels le benzène et le toluène.C’est en Angleterre, pays possédant déjà un important réseau d’usines à gaz, que furent créées les premières installations pour la production d’aniline et de colorants. L’Allemagne et la France suivirent de près, mais cette jeune industrie ne connut son plein essor qu’après 1865, grâce aux travaux scientifiques de Kekule sur la structure cyclique du benzène.Les sous-produits, jusqu’alors brûlés, devinrent des produits précieux que la fabrication du gaz d’éclairage ne parvenait plus à fournir en quantité suffisante, mais que les premières cokeries à récupération, apparues vers 1881 en Allemagne, allaient fournir en quantité importante. Au début du XXe siècle, on ne construisait plus aucun four à coke qui ne fût équipé d’une installation de récupération des sous-produits; et une industrie de la distillation des goudrons, bientôt suivie de celle des benzols, allait assurer une meilleure rentabilité des cokeries, tout en permettant un abaissement sensible du prix des matières premières de la nouvelle chimie organique (benzène, phénol, anthracène).C’est avant la Première Guerre mondiale et durant la période s’étendant de la naissance de l’industrie gazière à 1914 que l’on peut situer la première phase du développement de la carbochimie. Jusqu’à la Première Guerre mondiale, l’industrie de la chimie organique a été liée à la houille. Grandes consommatrices d’énergie, les usines chimiques se sont en effet, à leur naissance, souvent fixées près des houillères qui produisaient cette énergie.Après la guerre de 1914-1918, les besoins mondiaux augmentèrent si rapidement qu’il ne fut plus possible d’obtenir à partir des seuls produits de la houille toutes les matières premières dont avait besoin l’industrie chimique pour fabriquer les produits organiques de synthèse nouvellement apparus. Pendant cette deuxième période, furent mis au point les trois autres procédés de valorisation de la houille: la carbonisation à basse température, l’hydrogénation du charbon et la gazéification, cette dernière donnant plus particulièrement accès à la grande chimie de synthèse.Carbonisation à basse températureAu cours des cinquante dernières années, de nombreux essais ont été entrepris en vue de carboniser le charbon à des températures relativement basses: 500 à 700 0C, au lieu des températures de plus de 1 100 0C que l’on utilise dans les fours à coke traditionnels. Certains des essais entrepris ont été couronnés de succès sur le plan technique, mais non sur le plan économique, à cause des difficultés rencontrées dans l’écoulement des produits fabriqués, en particulier celui du goudron de basse température qui en constitue une base essentielle.Les procédés avaient pour objet initial la production de combustibles liquides à partir d’un charbon de qualité secondaire inapte à la carbonisation à haute température.On obtenait du semi-coke et, comme sous-produits, des goudrons riches en phénols, crésols et huiles légères, une essence brute aromatique, des eaux ammoniacales que l’on transformait en sulfate d’ammonium, des gaz riches dont le pouvoir calorifique supérieur dépassait 20 kJ/m3.Le but initial fut rapidement abandonné et l’on s’orienta vers la fabrication d’un «combustible sans fumée», complétée par l’obtention de produits liquides et gazeux qui ont assuré une meilleure rentabilité à l’opération.Hydrogénation de la houilleL’hydrogénation du charbon, qui fut une importante branche de la carbochimie allemande, a perdu de son intérêt initial, la fabrication des carburants liquides. Le procédé Bergius d’hydrogénation de la houille, découvert dès 1913, fut utilisé progressivement pour produire de l’essence (1 t d’essence pour 4 à 5 t de houille); il a fourni aux armées allemandes durant la Seconde Guerre mondiale une grande part de leur carburant.L’hydrogénation du charbon fut arrêtée, vers 1945, en république fédérale d’Allemagne et en Europe, car ses prix de revient sont plus élevés que ceux de l’essence de pétrole; les installations furent alors orientées vers le traitement des produits liquides pétroliers, en attendant la construction de nouvelles raffineries. L’hydrogénation de la houille a été, depuis, complètement abandonnée, mais elle s’inscrit dans les perspectives de la carbochimie (cf. infra ).GazéificationL’importance des mélanges à base d’oxyde de carbone et d’hydrogène est devenue telle, dans la chimie des grandes synthèses, qu’elle exerce une influence qui ira en croissant, car les besoins sont énormes. La gazéification des combustibles solides en présence de vapeur d’eau et d’oxygène a été, pendant longtemps, une source importante de ce gaz. Le gaz à l’eau, produit par gazéification du coke, était l’élément essentiel des grandes synthèses (méthanol, synthèse Fischer). L’utilisation du gaz à l’eau comme matière première pour la production d’hydrogène et d’oxyde de carbone offre l’avantage, comme tous les procédés de gazéification, d’une très grande indépendance technique et économique; mais c’est un procédé trop coûteux. On aurait pu utiliser des bas produits miniers, provenant du lavage des charbons, ou certains combustibles cendreux, par la technique d’une gazéification à température élevée en présence d’oxygène, mais on ne l’a guère fait; et, peu à peu, les gazogènes ont été abandonnés. Excepté le gaz de fours, le gaz de synthèse est maintenant obtenu par craquage ou reformage de méthane et de produits pétroliers.2. Bilan actuelAujourd’hui, la carbochimie est essentiellement fondée sur les produits résultant de la distillation du charbon à haute température. Dans ce procédé, on distille, vers 1 200 0C, une houille grasse comportant de 20 à 30 p. 100 de matières volatiles et l’on obtient par tonne de charbon enfournée (fig. 2): 700 à 800 kg de coke; 25 à 40 kg de goudrons; 7 à 12 kg de benzols; 1,4 à 2,6 kg d’ammoniac, donnant de 6 à 10 kg de sulfate d’ammonium; 300 à 350 m3 de gaz dont le pouvoir calorifique supérieur est de l’ordre de 20 kJ/m3.Le chauffage des batteries de fours à coke nécessite la combustion dans les piédroits d’un volume de gaz thermiquement égal à 45 p. 100 environ du gaz distillé.Le cokeLe coke, suivant ses qualités physiques qui dépendent de la nature du charbon enfourné ainsi que de la vitesse de cuisson et de dégazage, est destiné soit aux hauts fourneaux et à la fonderie, soit au chauffage, soit encore à l’industrie chimique.Dans ce dernier domaine, le coke a été longtemps à la base d’une vaste industrie de synthèse, en complément des ressources offertes par le gaz de fours, régularisant ainsi la marche des usines carbochimiques et leur évitant les vicissitudes de la sidérurgie.Jusqu’en 1950, les matières premières constituant la base des principales fabrications de synthèse, comme l’hydrogène, l’oxyde de carbone, le méthane, l’éthylène, l’acétylène, furent presque uniquement les produits solides et gazeux de la carbonisation. Le carbure de calcium a, en particulier, joué un grand rôle dans le développement de l’industrie chimique, servant à produire l’acétylène et ses dérivés. Ce procédé trouve maintenant des rivaux dans les procédés de craquage du gaz naturel ou du naphta: en Europe en 1980, 25 p. 100 seulement de la capacité de production, évaluée à 610 000 t, a utilisé le carbure de calcium (C2Ca). Le deuxième débouché du carbure de calcium est aussi en régression, il s’agit d’un engrais, le cyanamide calcique. Un débouché nouveau concerne l’industrie sidérurgique, celui de l’emploi de la fonte brute (5 à 10 kg de C2Ca par tonne de fonte).Le coke a, lui aussi, gardé son importance dans la fabrication du phosphore au four électrique et ce procédé se développera sans nul doute, à mesure que baissera le prix de l’énergie électrique.Les goudronsMis à part une quantité relativement faible utilisée telle quelle dans la sidérurgie, les goudrons sont distillés, après avoir été rassemblés dans quelques centres de traitement. Dans chacune de ces usines, le goudron est tout d’abord déshydraté. Ensuite, il est distillé, soit partiellement pour l’obtention de goudrons routiers, soit totalement pour la production de brais (50 à 55 p. 100) et d’huiles brutes (45 à 50 p. 100).Les brais servent à l’agglomération des charbons maigres et quart-gras; ils sont encore utilisés pour les produits imperméabilisants, les enduits, les peintures et les vernis de protection.Les huiles peuvent être obtenues en proportions variables en fonction de la conjoncture économique; elles sont fractionnées en plusieurs coupes d’où l’on retire toute une série de produits qui deviennent la matière première de diverses fabrications chimiques. C’est de cette façon que l’on sépare en particulier les composés benzéniques lourds, la coumarone, les composés phénoliques, les bases pyridiques, le naphtalène et l’anthracène qui représentent en poids 10 à 12 p. 100 du goudron brut distillé.Les phénols trouvent de multiples emplois dans l’industrie: produits pharmaceutiques, explosifs, matières colorantes et surtout textiles et résines synthétiques. C’est à partir de ces phénols que la première résine de condensation a été réalisée en 1909, par le Dr Baekeland, en combinant le formaldéhyde avec les phénols sous l’influence de la chaleur et de certains catalyseurs: les premières résines synthétiques du type thermodurcissable sont donc l’œuvre de la carbochimie.Les bases pyridiques sont surtout traitées pour l’industrie pharmaceutique qui les utilise dans la fabrication de certaines vitamines, d’alcaloïdes, de sulfamides et d’hydrazide isonicotinique.Le naphtalène est utilisé par les industries des colorants et des explosifs; la naphtaline est une des matières premières pour la fabrication de l’anhydride phtalique, produit de base pour l’obtention des résines glycérophtaliques et des polyesters. Bien que représentant une fraction notable de la distillation des goudrons (7 p. 100), la production de naphtaline est devenue insuffisante, d’où l’emploi de l’orthoxylène pétrolier comme matière première pour la fabrication de l’anhydride phtalique.L’anthracène est toujours utilisé dans la fabrication des matières colorantes et du noir de carbone.L’évolution de la production globale de goudron brut a suivi celle de la carbonisation; mais le rendement moyen à la tonne de charbon a baissé peu à peu, car la carbonisation a été de plus en plus utilisée pour produire du coke industriel, alors que les cokeries gazières, qui consomment des charbons riches en matières volatiles à hauts rendements en gaz et, partant, en goudrons, disparaissent peu à peu.L’écoulement des produits élaborés à partir des goudrons est toujours largement assuré; outre la route, il existe de très nombreux emplois chimiques et, chaque jour, de nouveaux besoins apparaissent que la carbochimie ne peut désormais satisfaire à elle seule.Les benzolsAprès élimination des goudrons et des eaux ammoniacales que l’on transforme en sulfate d’ammonium, on sépare les benzols du gaz de fours par lavage avec une huile solvante provenant de la distillation des goudrons. Le benzol brut ainsi obtenu est un mélange d’hydrocarbures volatils à prédominance aromatique et l’on y trouve, à côté du benzène (65 p. 100), du toluène (13 p. 100), du xylène (4 p. 100) et du «solvant naphta», des produits plus rares tel le cyclopentadiène, qui se prête à de nombreuses synthèses dans le domaine des produits pharmaceutiques, des parfums, des insecticides et des résines.La quantité de benzol obtenue varie selon la qualité des charbons enfournés et l’allure de la carbonisation.La grande industrie exige des produits benzéniques très purs, d’où la mise au point de procédés sévères d’épuration, comme l’hydrogénation catalytique sous pression des carbures non saturés ou le raffinage sulfurique sélectif qui permet, tout en éliminant les impuretés, de récupérer les carbures non saturés avec de faibles dépenses d’acide. On a ainsi une des sources des résines de coumarone et d’indène utilisées dans l’isolation électrique et dans les peintures.De tous ces produits, le benzène est celui dont la chimie est la plus développée. En 1980, l’Europe de l’Ouest a produit 3 800 000 t de benzène dont la quasi-totalité a été extraite des essences de reformage et de vapocraquage ou a résulté de l’hydrodésalkylation du toluène. La contribution du charbon est devenue négligeable alors qu’elle correspondait à 52 p. 100 en 1967. Il y a eu, ces dernières années, un fort accroissement de production qui a eu pour conséquence une baisse des prix du benzène et des autres carbures aromatiques. Le développement de l’emploi du benzène par l’industrie chimique est le résultat de l’accroissement considérable de la consommation de phénol de synthèse, de cyclohexane, de styrène, de détergents, de dérivés chlorés, d’aniline et d’acide maléique. La plupart de ces produits servent de matières premières à la fabrication des matières plastiques et des textiles synthétiques dont l’expansion est considérable.Le toluène est généralement excédentaire dans le monde entier, du fait d’une très forte production pétrolière, obtenue par des procédés non sélectifs pour les composés aromatiques. On l’emploie comme solvant et dans la fabrication du benzène par hydrodésalkylation; il remplace aussi ce dernier dans quelques synthèses comme celle du phénol ou du caprolactame, intermédiaire de la fabrication du nylon 6. Dans certains pays, il intervient dans la fabrication des carburants, ce qui permet de régulariser une production croissante.Les xylènes sont également excédentaires, malgré un développement des isomères purs pour la fabrication de l’anhydride phtalique (en remplacement de la naphtaline insuffisante) et de l’acide téréphtalique pour la fabrication des textiles synthétiques du type polyester. L’excédent est également utilisé par certains pays dans la fabrication des carburants.Le gaz de foursAprès avoir été débarrassé des goudrons, de l’ammoniac et des benzols qu’il contient, le gaz de fours répond à la composition volumétrique suivante: hydrogène (50 à 60 p. 100), méthane (25 à 30 p. 100), oxyde de carbone (6 à 8 p. 100), azote (5 à 6 p. 100), alcènes (1,5 à 3 p. 100), gaz carbonique, hydrogène sulfuré et divers (1 à 2 p. 100).Une des difficultés essentielles de l’emploi d’un tel gaz comme matière première réside dans le mélange complexe dont il est formé. Il a fallu faire appel aux méthodes de liquéfaction fractionnée des gaz à basse température pour en séparer les divers éléments. Le plus important de tous est l’hydrogène, et son utilisation a été développée par de nombreuses usines d’ammoniac synthétique, fonctionnant à partir des procédés Haber, Claude, Casale, Fauser, fondés sur la réaction d’équilibre:
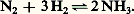 Le complément d’azote nécessaire à la réaction est généralement fourni par un appareil de liquéfaction qui sépare, avec une pureté suffisante, l’azote et l’oxygène des autres constituants de l’air. Dans ce cas, l’oxygène obtenu est un sous-produit qu’il est facile de valoriser (cf. infra ).En 1918, Georges Claude entreprit des expériences de laboratoire se rapportant à la synthèse de l’ammoniac sous très haute pression. Après quelques essais satisfaisants, à une échelle semi-industrielle, il décida, vers 1920, de monter dans une usine de Montereau une petite «unité» de fabrication d’ammoniac à partir du gaz à l’eau.Peu après, l’appareil de fabrication d’hydrogène utilisé par Georges Claude fut modifié, de manière à traiter le gaz de fours à coke par la méthode de liquéfaction des gaz à basse température.Dans ce domaine difficile et encore bien mystérieux, Georges Claude poussa plus avant les recherches de Linde, en faisant usage de la détente des gaz avec travail extérieur, et il fut le premier à construire un détendeur qui travaillât d’une façon satisfaisante dans la région des basses températures (face=F0019 漣 200 0C). L’idée de Georges Claude était alors de perfectionner l’effet frigorifique très faible de la détente Thomson-Joule, car la détente avec travail extérieur provoque un abaissement de température beaucoup plus important. Grâce à ses travaux, s’organisait en France, en 1922, aux usines de Mazingarbe une petite unité d’ammoniac, la première au monde. Elle allait utiliser industriellement l’hydrogène du gaz de fours à coke et permettre la sélection dans ce gaz de divers composés qui allaient être à la base de nouvelles fabrications chimiques. Il faut traiter 4 m3 de gaz de fours pour obtenir l’hydrogène correspondant à un kilo d’ammoniac.La liquéfaction du gaz de fours produit, en dehors de l’hydrogène, des quantités importantes de gaz résiduels contenant de l’éthylène et du méthane. Si la fraction éthylénique qui contient l’éthylène, l’éthane et le propylène a été employée, bien avant 1940, dans une chimie nouvelle, le gaz riche en méthane n’était généralement utilisé qu’au chauffage des fours et, pour une faible partie, dans la distribution urbaine.Mais, si les usines de synthèse traitent la totalité du gaz de fours des cokeries, il y a disproportion entre les besoins calorifiques de la cokerie, généralement inférieurs à 50 p. 100 du gaz distillé, et la production de gaz résiduel dont les calories dépassent 60 p. 100 du gaz traité; d’où la nécessité d’utiliser le méthane dans l’usine de synthèse elle-même, si l’on veut résoudre d’une façon économique le problème du gaz excédentaire que les réseaux ne permettent pas toujours d’évacuer. Des procédés de décomposition du méthane ont été étudiés pour produire de nouvelles quantités d’oxyde de carbone et d’hydrogène, et les techniques du craquage catalytique sont maintenant bien connues. On opère généralement sous pression; celle-ci peut atteindre 2,5 à 3 MPa pour les procédés de reformage et près de 10 MPa pour ceux de craquage à l’oxygène, ce qui procure une économie sensible d’énergie.L’oxygène utilisé peut être le sous-produit de la fabrication de l’azote par liquéfaction de l’air; cela aiderait à fixer le choix du procédé de craquage le plus économique dans certaines usines de fabrication d’ammoniac.Le mélange d’hydrogène et de monoxyde de carbone produit est à la base des grandes synthèses du méthanol et des synthèses d’alcools lourds.Le craquage du méthane, en vue de la production de l’acétylène, est actuellement possible en utilisant plusieurs méthodes (craquage électrique ou craquage oxydant). Ces procédés sont en concurrence avec celui du carbure de calcium cité plus haut, mais le choix dépend surtout des circonstances locales.Le mélange alcénique, retiré du gaz de fours, contient environ 30 à 35 p. 100 d’éthylène, 10 à 15 p. 100 d’éthane, 2 à 3 p. 100 de propylène, le reste étant du méthane et de l’azote; par liquéfaction fractionnée à basse température, on sépare l’éthylène, l’éthane, le propylène et le méthane; l’éthane, traité par craquage thermique, redonne de l’éthylène et de l’hydrogène, tous deux réutilisés, et l’on peut obtenir 60 m3 d’éthylène et 5 à 6 m3 de propylène par tonne d’ammoniac fabriqué. Ces deux matières premières sont à la base d’importantes fabrications chimiques: par absorption de l’éthylène ou du propylène au moyen de l’acide sulfurique, on peut produire des alcools éthylique et isopropylique; par traitement au chlore, on obtient, après saponification à la chaux et distillation, des oxydes d’éthylène et de propylène, bases des glycols, des éthanolamines et des détergents, mais l’oxyde d’éthylène peut maintenant être produit plus économiquement par oxydation directe à 200 0C de l’éthylène concentré en présence d’un catalyseur à base d’argent; par polymérisation à 200 0C sous une pression élevée (150 MPa) avec l’aide d’un catalyseur gazeux, on obtient le polyéthylène haute pression et, en opérant à pression beaucoup plus basse avec certains types de catalyseurs (à base de métaux), on obtient le polyéthylène basse pression (ou haute densité); par une réaction d’alcoylation entre l’éthylène et le benzène, on obtient le styrolène, qui est utilisé dans la fabrication de polystyrènes, du caoutchouc S.B.R. (Styrene-Butadiene Rubber) et des polyesters.Dans l’industrie des résines polyesters thermodurcissables, la carbochimie occupe une position privilégiée, car elle dispose des matières premières nécessaires (glycols, anhydride phtalique, acide maléique, styrène). Leurs applications seront de plus en plus nombreuses dans les domaines du bâtiment, de l’industrie automobile et de la construction navale.La carbochimie et la valorisation de la houilleL’emploi du charbon comme matière de base pour l’industrie chimique représente, à l’heure actuelle, un petit marché en comparaison des usages primordiaux du charbon pour la production d’énergie et d’acier; mais ce faible pourcentage est pourtant mieux valorisé qu’autrefois, et cela d’abord par la technique de la carbonisation qui consomme en Europe près de 30 p. 100 de la production totale de houille.En Europe occidentale, riche en combustibles solides, mais encore pauvre en produits liquides et gazeux, malgré quelques découvertes récentes, ce sont les Pays-Bas qui atteignent le plus grand pourcentage de houille transformée en produits chimiques, grâce aux Staatsmijnen qui ont réalisé, dans ce domaine, une progression spectaculaire en poussant l’utilisation des matières carbochimiques jusqu’à l’extrême limite de leur évolution.3. Perspectives de développementDepuis le début de son développement, dans les deux dernières décennies du XIXe siècle, jusqu’aux environs des années cinquante, la carbochimie était la source presque exclusive des composés nécessaires à l’industrie chimique. Le prodigieux développement de la pétrochimie l’a très rapidement ramenée au second plan. C’est ainsi qu’en Europe, en 1950, 95 p. 100 des produits chimiques organiques étaient d’origine charbonnière, alors que, en 1970, 90 p. 100 des produits organiques étaient d’origine pétrochimique. Cette supplantation quasi totale fut justifiée par deux avantages non négligeables du pétrole par rapport au charbon: le premier est un liquide, donc relativement facile à extraire du sol, à transporter, à stocker, à distribuer, alors que l’extraction du second nécessite des installations minières souvent complexes et qu’il est difficile de le transporter et de le distribuer. De plus, le pouvoir calorifique du pétrole brut (41,85.106 kJ/t) est bien supérieur à celui du charbon (de 20,92 à 25,11.106 kJ/t). Ajoutons aux inconvénients du charbon celui d’une faible teneur en hydrogène: (formule moyenne CH0,8), par rapport à celle du pétrole brut (CH1,8) et d’une teneur en cendres variable, mais jamais négligeable, qui pose des problèmes dans la mise en œuvre des procédés et dans la protection de l’environnement. Enfin, ce qui reste de la carbochimie est lié à la fabrication du coke, industrie très lourde qui subit les difficultés économiques et sociales que l’on connaît.Mais, depuis 1973, les différents chocs pétroliers ont sensibilisé les industriels à la vulnérabilité et au caractère éphémère de notre ravitaillement en matières premières carbonées. Si des sources d’énergie autres que le pétrole brut peuvent être envisagées pour diversifier nos approvisionnements, en ce qui concerne les sources de carbone, le charbon semble s’imposer non seulement parce que ses réserves sont énormes – les réserves actuellement prouvées correspondent à deux siècles de notre consommation actuelle –, mais surtout parce qu’elles sont géographiquement bien réparties.On devrait donc assister à une réhabilitation de la carbochimie, toutefois sous une forme différente de celle que l’on a connue. On cherchera à éviter les inconvénients inhérents à l’état solide du charbon soit en le liquéfiant, soit en le gazéifiant après extraction, et même in situ . Une nouvelle chimie résultera de la gazéification productrice de gaz de synthèse (CO + H2) qui s’ajoutera à la chimie plus classique des goudrons de houille et de l’acétylène.La liquéfaction du charbonIl s’agit d’obtenir des produits hydrocarbonés à plus forte teneur en hydrogène que le charbon de départ. On parvient à ce but de deux façons: soit en éliminant du carbone par pyrolyse, soit en ajoutant de l’hydrogène par hydrogénation.Les procédés de pyrolyse, jusqu’alors destinés à la production de coke ou de gaz de ville, peuvent être orientés vers une production plus importante de liquides (pyrolyse flash). L’hydrogénation, déjà pratiquée durant la dernière guerre en Allemagne (procédé Bergius), est en réalité une pyrolyse hydrogénante. De nombreux procédés se développent actuellement sur cette technique qui peut traiter soit du charbon pulvérisé, soit un extrait de charbon obtenu par dissolution dans une huile anthracénique vers 400 0C (procédé «Donar Solvent» d’Exxon, procédé «H-coal» d’Hydrocarbon Research, procédé «Solvent Refining» de Gulf, Ruhrkohle, Steag, etc.). Si la majeure partie des hydrogénats peut constituer une source future de carburants et de combustibles, elle peut aussi alimenter une nouvelle carbochimie qui résulterait de l’extraction des aromatiques et du vapocraquage des fractions légères.La gazéification du charbonLa gazéification souterraineLa gazéification souterraine consiste à faire réagir in situ le charbon sur de l’air et à recueillir les gaz de combustion. Cette technique n’est pas nouvelle, puisqu’elle a été expérimentée en U.R.S.S. depuis 1930 et aux États-Unis entre 1948 et 1962. Elle se heurte à d’énormes difficultés, résultant entre autres: des fuites d’air et de gaz à travers les couches de terrain entourant la veine de charbon, des venues d’eaux, de l’effondrement du toit de la veine, et, d’une façon générale, de l’impossibilité actuelle de maîtriser le phénomène. Cependant, l’enjeu est considérable et justifie les travaux actuellement repris dans ce domaine aux États-Unis et en Europe. Cette technique permettrait, sans nécessiter la pénible intervention de l’homme sous terre, de valoriser d’énormes ressources actuellement inexploitables, en particulier pour les veines situées à des profondeurs supérieures à 1 000 m. Le gaz recueilli après injection d’air a un pouvoir calorifique très faible: 4 à 6.106 J/m3 (le gaz naturel a un pouvoir calorifique d’environ 37.106 J/m3). On peut recueillir un gaz plus riche en injectant, à la place de l’air, un mélange d’oxygène et de vapeur d’eau. Ce gaz pourrait servir à la production d’électricité, mais aussi à des synthèses chimiques. Les possibilités réelles de la gazéification souterraine ne seront probablement pas définies avant une dizaine d’années.La gazéification après extractionDans le cas de la gazéification après extraction, il s’agit de la réaction du charbon sur l’oxygène et la vapeur d’eau, qui conduit à un mélange de monoxyde de carbone et d’hydrogène, le gaz de synthèse:
Le complément d’azote nécessaire à la réaction est généralement fourni par un appareil de liquéfaction qui sépare, avec une pureté suffisante, l’azote et l’oxygène des autres constituants de l’air. Dans ce cas, l’oxygène obtenu est un sous-produit qu’il est facile de valoriser (cf. infra ).En 1918, Georges Claude entreprit des expériences de laboratoire se rapportant à la synthèse de l’ammoniac sous très haute pression. Après quelques essais satisfaisants, à une échelle semi-industrielle, il décida, vers 1920, de monter dans une usine de Montereau une petite «unité» de fabrication d’ammoniac à partir du gaz à l’eau.Peu après, l’appareil de fabrication d’hydrogène utilisé par Georges Claude fut modifié, de manière à traiter le gaz de fours à coke par la méthode de liquéfaction des gaz à basse température.Dans ce domaine difficile et encore bien mystérieux, Georges Claude poussa plus avant les recherches de Linde, en faisant usage de la détente des gaz avec travail extérieur, et il fut le premier à construire un détendeur qui travaillât d’une façon satisfaisante dans la région des basses températures (face=F0019 漣 200 0C). L’idée de Georges Claude était alors de perfectionner l’effet frigorifique très faible de la détente Thomson-Joule, car la détente avec travail extérieur provoque un abaissement de température beaucoup plus important. Grâce à ses travaux, s’organisait en France, en 1922, aux usines de Mazingarbe une petite unité d’ammoniac, la première au monde. Elle allait utiliser industriellement l’hydrogène du gaz de fours à coke et permettre la sélection dans ce gaz de divers composés qui allaient être à la base de nouvelles fabrications chimiques. Il faut traiter 4 m3 de gaz de fours pour obtenir l’hydrogène correspondant à un kilo d’ammoniac.La liquéfaction du gaz de fours produit, en dehors de l’hydrogène, des quantités importantes de gaz résiduels contenant de l’éthylène et du méthane. Si la fraction éthylénique qui contient l’éthylène, l’éthane et le propylène a été employée, bien avant 1940, dans une chimie nouvelle, le gaz riche en méthane n’était généralement utilisé qu’au chauffage des fours et, pour une faible partie, dans la distribution urbaine.Mais, si les usines de synthèse traitent la totalité du gaz de fours des cokeries, il y a disproportion entre les besoins calorifiques de la cokerie, généralement inférieurs à 50 p. 100 du gaz distillé, et la production de gaz résiduel dont les calories dépassent 60 p. 100 du gaz traité; d’où la nécessité d’utiliser le méthane dans l’usine de synthèse elle-même, si l’on veut résoudre d’une façon économique le problème du gaz excédentaire que les réseaux ne permettent pas toujours d’évacuer. Des procédés de décomposition du méthane ont été étudiés pour produire de nouvelles quantités d’oxyde de carbone et d’hydrogène, et les techniques du craquage catalytique sont maintenant bien connues. On opère généralement sous pression; celle-ci peut atteindre 2,5 à 3 MPa pour les procédés de reformage et près de 10 MPa pour ceux de craquage à l’oxygène, ce qui procure une économie sensible d’énergie.L’oxygène utilisé peut être le sous-produit de la fabrication de l’azote par liquéfaction de l’air; cela aiderait à fixer le choix du procédé de craquage le plus économique dans certaines usines de fabrication d’ammoniac.Le mélange d’hydrogène et de monoxyde de carbone produit est à la base des grandes synthèses du méthanol et des synthèses d’alcools lourds.Le craquage du méthane, en vue de la production de l’acétylène, est actuellement possible en utilisant plusieurs méthodes (craquage électrique ou craquage oxydant). Ces procédés sont en concurrence avec celui du carbure de calcium cité plus haut, mais le choix dépend surtout des circonstances locales.Le mélange alcénique, retiré du gaz de fours, contient environ 30 à 35 p. 100 d’éthylène, 10 à 15 p. 100 d’éthane, 2 à 3 p. 100 de propylène, le reste étant du méthane et de l’azote; par liquéfaction fractionnée à basse température, on sépare l’éthylène, l’éthane, le propylène et le méthane; l’éthane, traité par craquage thermique, redonne de l’éthylène et de l’hydrogène, tous deux réutilisés, et l’on peut obtenir 60 m3 d’éthylène et 5 à 6 m3 de propylène par tonne d’ammoniac fabriqué. Ces deux matières premières sont à la base d’importantes fabrications chimiques: par absorption de l’éthylène ou du propylène au moyen de l’acide sulfurique, on peut produire des alcools éthylique et isopropylique; par traitement au chlore, on obtient, après saponification à la chaux et distillation, des oxydes d’éthylène et de propylène, bases des glycols, des éthanolamines et des détergents, mais l’oxyde d’éthylène peut maintenant être produit plus économiquement par oxydation directe à 200 0C de l’éthylène concentré en présence d’un catalyseur à base d’argent; par polymérisation à 200 0C sous une pression élevée (150 MPa) avec l’aide d’un catalyseur gazeux, on obtient le polyéthylène haute pression et, en opérant à pression beaucoup plus basse avec certains types de catalyseurs (à base de métaux), on obtient le polyéthylène basse pression (ou haute densité); par une réaction d’alcoylation entre l’éthylène et le benzène, on obtient le styrolène, qui est utilisé dans la fabrication de polystyrènes, du caoutchouc S.B.R. (Styrene-Butadiene Rubber) et des polyesters.Dans l’industrie des résines polyesters thermodurcissables, la carbochimie occupe une position privilégiée, car elle dispose des matières premières nécessaires (glycols, anhydride phtalique, acide maléique, styrène). Leurs applications seront de plus en plus nombreuses dans les domaines du bâtiment, de l’industrie automobile et de la construction navale.La carbochimie et la valorisation de la houilleL’emploi du charbon comme matière de base pour l’industrie chimique représente, à l’heure actuelle, un petit marché en comparaison des usages primordiaux du charbon pour la production d’énergie et d’acier; mais ce faible pourcentage est pourtant mieux valorisé qu’autrefois, et cela d’abord par la technique de la carbonisation qui consomme en Europe près de 30 p. 100 de la production totale de houille.En Europe occidentale, riche en combustibles solides, mais encore pauvre en produits liquides et gazeux, malgré quelques découvertes récentes, ce sont les Pays-Bas qui atteignent le plus grand pourcentage de houille transformée en produits chimiques, grâce aux Staatsmijnen qui ont réalisé, dans ce domaine, une progression spectaculaire en poussant l’utilisation des matières carbochimiques jusqu’à l’extrême limite de leur évolution.3. Perspectives de développementDepuis le début de son développement, dans les deux dernières décennies du XIXe siècle, jusqu’aux environs des années cinquante, la carbochimie était la source presque exclusive des composés nécessaires à l’industrie chimique. Le prodigieux développement de la pétrochimie l’a très rapidement ramenée au second plan. C’est ainsi qu’en Europe, en 1950, 95 p. 100 des produits chimiques organiques étaient d’origine charbonnière, alors que, en 1970, 90 p. 100 des produits organiques étaient d’origine pétrochimique. Cette supplantation quasi totale fut justifiée par deux avantages non négligeables du pétrole par rapport au charbon: le premier est un liquide, donc relativement facile à extraire du sol, à transporter, à stocker, à distribuer, alors que l’extraction du second nécessite des installations minières souvent complexes et qu’il est difficile de le transporter et de le distribuer. De plus, le pouvoir calorifique du pétrole brut (41,85.106 kJ/t) est bien supérieur à celui du charbon (de 20,92 à 25,11.106 kJ/t). Ajoutons aux inconvénients du charbon celui d’une faible teneur en hydrogène: (formule moyenne CH0,8), par rapport à celle du pétrole brut (CH1,8) et d’une teneur en cendres variable, mais jamais négligeable, qui pose des problèmes dans la mise en œuvre des procédés et dans la protection de l’environnement. Enfin, ce qui reste de la carbochimie est lié à la fabrication du coke, industrie très lourde qui subit les difficultés économiques et sociales que l’on connaît.Mais, depuis 1973, les différents chocs pétroliers ont sensibilisé les industriels à la vulnérabilité et au caractère éphémère de notre ravitaillement en matières premières carbonées. Si des sources d’énergie autres que le pétrole brut peuvent être envisagées pour diversifier nos approvisionnements, en ce qui concerne les sources de carbone, le charbon semble s’imposer non seulement parce que ses réserves sont énormes – les réserves actuellement prouvées correspondent à deux siècles de notre consommation actuelle –, mais surtout parce qu’elles sont géographiquement bien réparties.On devrait donc assister à une réhabilitation de la carbochimie, toutefois sous une forme différente de celle que l’on a connue. On cherchera à éviter les inconvénients inhérents à l’état solide du charbon soit en le liquéfiant, soit en le gazéifiant après extraction, et même in situ . Une nouvelle chimie résultera de la gazéification productrice de gaz de synthèse (CO + H2) qui s’ajoutera à la chimie plus classique des goudrons de houille et de l’acétylène.La liquéfaction du charbonIl s’agit d’obtenir des produits hydrocarbonés à plus forte teneur en hydrogène que le charbon de départ. On parvient à ce but de deux façons: soit en éliminant du carbone par pyrolyse, soit en ajoutant de l’hydrogène par hydrogénation.Les procédés de pyrolyse, jusqu’alors destinés à la production de coke ou de gaz de ville, peuvent être orientés vers une production plus importante de liquides (pyrolyse flash). L’hydrogénation, déjà pratiquée durant la dernière guerre en Allemagne (procédé Bergius), est en réalité une pyrolyse hydrogénante. De nombreux procédés se développent actuellement sur cette technique qui peut traiter soit du charbon pulvérisé, soit un extrait de charbon obtenu par dissolution dans une huile anthracénique vers 400 0C (procédé «Donar Solvent» d’Exxon, procédé «H-coal» d’Hydrocarbon Research, procédé «Solvent Refining» de Gulf, Ruhrkohle, Steag, etc.). Si la majeure partie des hydrogénats peut constituer une source future de carburants et de combustibles, elle peut aussi alimenter une nouvelle carbochimie qui résulterait de l’extraction des aromatiques et du vapocraquage des fractions légères.La gazéification du charbonLa gazéification souterraineLa gazéification souterraine consiste à faire réagir in situ le charbon sur de l’air et à recueillir les gaz de combustion. Cette technique n’est pas nouvelle, puisqu’elle a été expérimentée en U.R.S.S. depuis 1930 et aux États-Unis entre 1948 et 1962. Elle se heurte à d’énormes difficultés, résultant entre autres: des fuites d’air et de gaz à travers les couches de terrain entourant la veine de charbon, des venues d’eaux, de l’effondrement du toit de la veine, et, d’une façon générale, de l’impossibilité actuelle de maîtriser le phénomène. Cependant, l’enjeu est considérable et justifie les travaux actuellement repris dans ce domaine aux États-Unis et en Europe. Cette technique permettrait, sans nécessiter la pénible intervention de l’homme sous terre, de valoriser d’énormes ressources actuellement inexploitables, en particulier pour les veines situées à des profondeurs supérieures à 1 000 m. Le gaz recueilli après injection d’air a un pouvoir calorifique très faible: 4 à 6.106 J/m3 (le gaz naturel a un pouvoir calorifique d’environ 37.106 J/m3). On peut recueillir un gaz plus riche en injectant, à la place de l’air, un mélange d’oxygène et de vapeur d’eau. Ce gaz pourrait servir à la production d’électricité, mais aussi à des synthèses chimiques. Les possibilités réelles de la gazéification souterraine ne seront probablement pas définies avant une dizaine d’années.La gazéification après extractionDans le cas de la gazéification après extraction, il s’agit de la réaction du charbon sur l’oxygène et la vapeur d’eau, qui conduit à un mélange de monoxyde de carbone et d’hydrogène, le gaz de synthèse: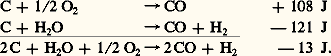 Actuellement, trois procédés industriels permettent de réaliser cette transformation. Il s’agit du procédé Lurgi, sous pression, en lit fixe, alimenté par du charbon en grains et qui fonctionne en Afrique du Sud dans les deux usines Sasol à Sasolburg; du procédé Koppers-Totzek, avec du charbon en poudre, à la pression atmosphérique et dont une unité fonctionne en Afrique du Sud; enfin, du procédé Winkler, en lit fluidisé, qui a fonctionné en Allemagne pendant la dernière guerre pour la production d’hydrocarbures par le procédé Fischer-Tropsch.Une nouvelle génération de gazogènes industriels est en cours de développement; les mieux adaptés à la production de gaz de synthèse pour la chimie semblent être les systèmes Shell-Koppers et Otto Saarbergwerk qui opèrent avec du charbon pulvérisé sous pression et évacuent les cendres sous forme liquide, et le gazogène Texaco où le charbon est introduit en suspension dans l’eau. Le progrès technique réalisé dans les gazogènes et l’évolution favorable du prix du charbon par rapport à celui du pétrole devraient étendre, dans l’avenir, l’emploi du gaz de synthèse en chimie.Actuellement, l’ammoniac et le méthanol sont fabriqués à partir de ce gaz, lui-même obtenu à partir de gaz naturel ou de naphta. Ces deux produits pourraient être synthétisés à partir du charbon, de même que les alcools «oxo». Le méthanol peut devenir un intermédiaire de base important pour la production d’essence par le procédé Mobil, pour la préparation de carburants de substitution (mélanges de méthanol, d’acétone et de butanol) ou pour la synthèse d’acide acétique par carbonylation (procédé Monsanto), ou encore pour la synthèse d’un nouveau constituant des essences, le méthyl-tertio-butyl-éther (M.T.B.E.). Mais le développement de la chimie de l’oxyde de carbone et de l’hydrogène laisse prévoir de nouvelles synthèses industrielles. Déjà, l’éthylène-glycol peut être obtenu directement à partir de gaz de synthèse par le procédé Union Carbide, et d’autres synthèses sont à l’étude.Il reste le retour à la carbochimie traditionnelle fondée sur la cokéfaction du charbon. Il est obligatoirement limité par la production du coke sidérurgique qui plafonne en France à environ 10 millions de tonnes par an. En ce qui concerne l’acétylène issu du coke en passant par le carbure de calcium, produit de départ idéal de la synthèse de nombreux composés vinyliques, sa réhabilitation dépendra du coût de l’énergie. En effet, la synthèse du carbure de calcium se fait à haute température (2 000 0C) et nécessite une grande consommation d’énergie électrique. Il est possible que, dans l’avenir, l’énergie électrique d’origine nucléaire puisse, aux heures creuses, rendre cette synthèse économiquement valable.Ainsi, sans se substituer totalement à la pétrochimie qui restera encore longtemps la principale source de composés organiques, la carbochimie devrait, dans les années à venir, reprendre une partie de l’intérêt qu’elle avait perdu. Dans les pays où le charbon est d’un accès facile, on devrait voir se développer des complexes du type de celui de l’U.S. Steel (fig. 3) aux États-Unis, près de Pittsburg, où le charbon alimente sur un même site des unités productrices d’énergie, de produits chimiques et d’acier.
Actuellement, trois procédés industriels permettent de réaliser cette transformation. Il s’agit du procédé Lurgi, sous pression, en lit fixe, alimenté par du charbon en grains et qui fonctionne en Afrique du Sud dans les deux usines Sasol à Sasolburg; du procédé Koppers-Totzek, avec du charbon en poudre, à la pression atmosphérique et dont une unité fonctionne en Afrique du Sud; enfin, du procédé Winkler, en lit fluidisé, qui a fonctionné en Allemagne pendant la dernière guerre pour la production d’hydrocarbures par le procédé Fischer-Tropsch.Une nouvelle génération de gazogènes industriels est en cours de développement; les mieux adaptés à la production de gaz de synthèse pour la chimie semblent être les systèmes Shell-Koppers et Otto Saarbergwerk qui opèrent avec du charbon pulvérisé sous pression et évacuent les cendres sous forme liquide, et le gazogène Texaco où le charbon est introduit en suspension dans l’eau. Le progrès technique réalisé dans les gazogènes et l’évolution favorable du prix du charbon par rapport à celui du pétrole devraient étendre, dans l’avenir, l’emploi du gaz de synthèse en chimie.Actuellement, l’ammoniac et le méthanol sont fabriqués à partir de ce gaz, lui-même obtenu à partir de gaz naturel ou de naphta. Ces deux produits pourraient être synthétisés à partir du charbon, de même que les alcools «oxo». Le méthanol peut devenir un intermédiaire de base important pour la production d’essence par le procédé Mobil, pour la préparation de carburants de substitution (mélanges de méthanol, d’acétone et de butanol) ou pour la synthèse d’acide acétique par carbonylation (procédé Monsanto), ou encore pour la synthèse d’un nouveau constituant des essences, le méthyl-tertio-butyl-éther (M.T.B.E.). Mais le développement de la chimie de l’oxyde de carbone et de l’hydrogène laisse prévoir de nouvelles synthèses industrielles. Déjà, l’éthylène-glycol peut être obtenu directement à partir de gaz de synthèse par le procédé Union Carbide, et d’autres synthèses sont à l’étude.Il reste le retour à la carbochimie traditionnelle fondée sur la cokéfaction du charbon. Il est obligatoirement limité par la production du coke sidérurgique qui plafonne en France à environ 10 millions de tonnes par an. En ce qui concerne l’acétylène issu du coke en passant par le carbure de calcium, produit de départ idéal de la synthèse de nombreux composés vinyliques, sa réhabilitation dépendra du coût de l’énergie. En effet, la synthèse du carbure de calcium se fait à haute température (2 000 0C) et nécessite une grande consommation d’énergie électrique. Il est possible que, dans l’avenir, l’énergie électrique d’origine nucléaire puisse, aux heures creuses, rendre cette synthèse économiquement valable.Ainsi, sans se substituer totalement à la pétrochimie qui restera encore longtemps la principale source de composés organiques, la carbochimie devrait, dans les années à venir, reprendre une partie de l’intérêt qu’elle avait perdu. Dans les pays où le charbon est d’un accès facile, on devrait voir se développer des complexes du type de celui de l’U.S. Steel (fig. 3) aux États-Unis, près de Pittsburg, où le charbon alimente sur un même site des unités productrices d’énergie, de produits chimiques et d’acier.
Encyclopédie Universelle. 2012.
